循环肿瘤细胞(CTC)是从原发肿瘤部位分离并进入血液循环,是驱动癌症转移的关键因素,与肿瘤复发转移密切相关,作为液体活检的首选样本,为监测肿瘤转移、评估治疗反应和预后提供了一种方便、有效的方法。在许多其他癌症中,外周血中CTC的计数已被证明是肿瘤患者的独立预后指标。
CTC通过上皮-间质转化(EMT)机制穿透血管壁进入到血液中,其中血管内皮生长因子受体2(VEGFR2)是VEGF的关键受体,是血管生成的必要条件,其在肝癌(HCC)肿瘤组织中表达典型地上调。多项研究报道了VEGFR2在乳腺癌、肺癌和结肠直肠癌CTC中的表达,提示VEGFR2可能在CTC生物学功能中发挥重要作用[1]。然而,在HCC-CTC中VEGFR2表达的机制尚不清楚,探索VEGFR2在CTC中的表达、与CTC的形成等相关机制,有助于开发新的肝癌靶向治疗疗效预测工具。

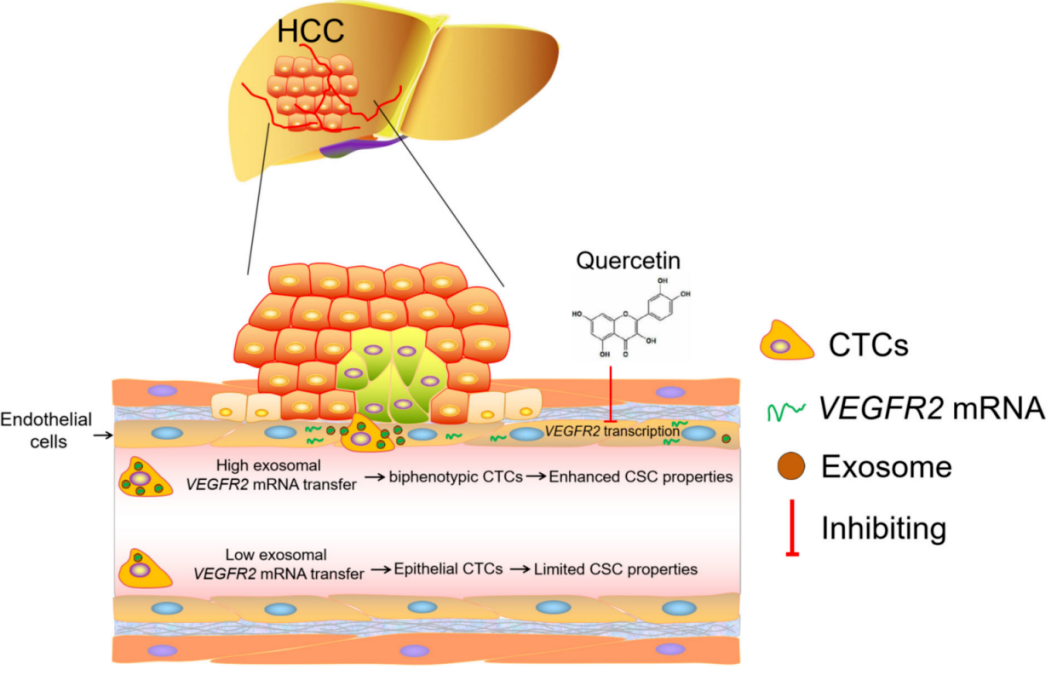
近日,四川省人民医院肝胆外科、肿瘤科联合四川大学华西医院生物治疗与癌症中心国家重点实验室基于CanPatrol® CTC分型检测技术平台[2],研究VEGFR2在HCC CTC中的表达,结合各项基础实验,探索VEGFR2在HCC癌细胞侵袭、转移和CTC形成的相关机制研究,并发现槲皮素(一种类黄酮,在HCC中,槲皮素可以抑制细胞周期进程,触发细胞凋亡,槲皮素通过抑制VEGFR2的表达及其磷酸化,具有众所周知的抗血管生成作用)可减少VEGFR2 mRNA通过内皮细胞向HCC细胞的转移,降低了CTC和VEGFR2阳性CTC的比例,或可成为VEGFR2+CTC的靶向治疗抑制剂。
● PMID:39171838
研究方法
![]()
研究结果
![]()
▎HCC的CTC中可检测到VEGFR2 mRNA表达
这些发现表明,VEGFR2的表达在HCC-CTC中很常见。基于这一观察结果,研究人员推测VEGFR2 mRNA可能并不仅仅来源于HCC细胞内的从头转录,而是可以从肿瘤微环境(TME)中获得。
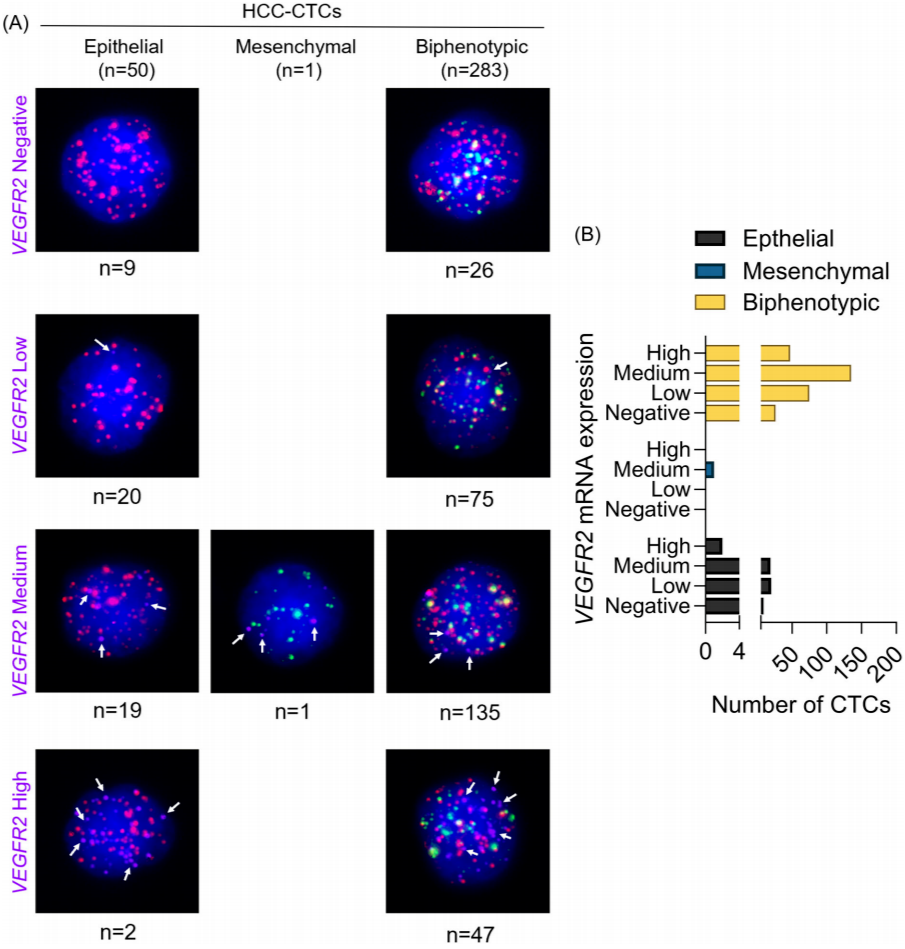
▲图1 HCC-CTC中VEGFR2的表达情况
-
▎VEGFR2与肝癌肿瘤细胞表达差异
-在人类癌细胞系的转录组数据中分析VEGFR2在HCC癌细胞系中的表达谱,在纳入的HCC细胞系中,只有JHH-2和SNU-182的VEGFR2表达量高于log2(TPM+1)>1 (图2A);
-基于免疫组化结果,发现在血管细胞中VEGFR2表达阳性,而在HCC肿瘤细胞中普遍表达阴性,但在穿透血管的细胞(可能包括肿瘤细胞)显示VEGFR2染色阳性(图2B,红色箭头);
-内皮细胞和成纤维细胞的VEGFR2表达最高,而其他细胞类型,包括巨噬细胞和肝细胞的VEGFR2表达有限但可检测到(图2C);
-人肝纤维化和HCC组织中VEGFR2单细胞RNA水平的基因表达对比发现,在一些肝细胞中,包括HCC肿瘤细胞中检测到HCC TME,VEGFR2mRNA(图2D,红色圆圈)
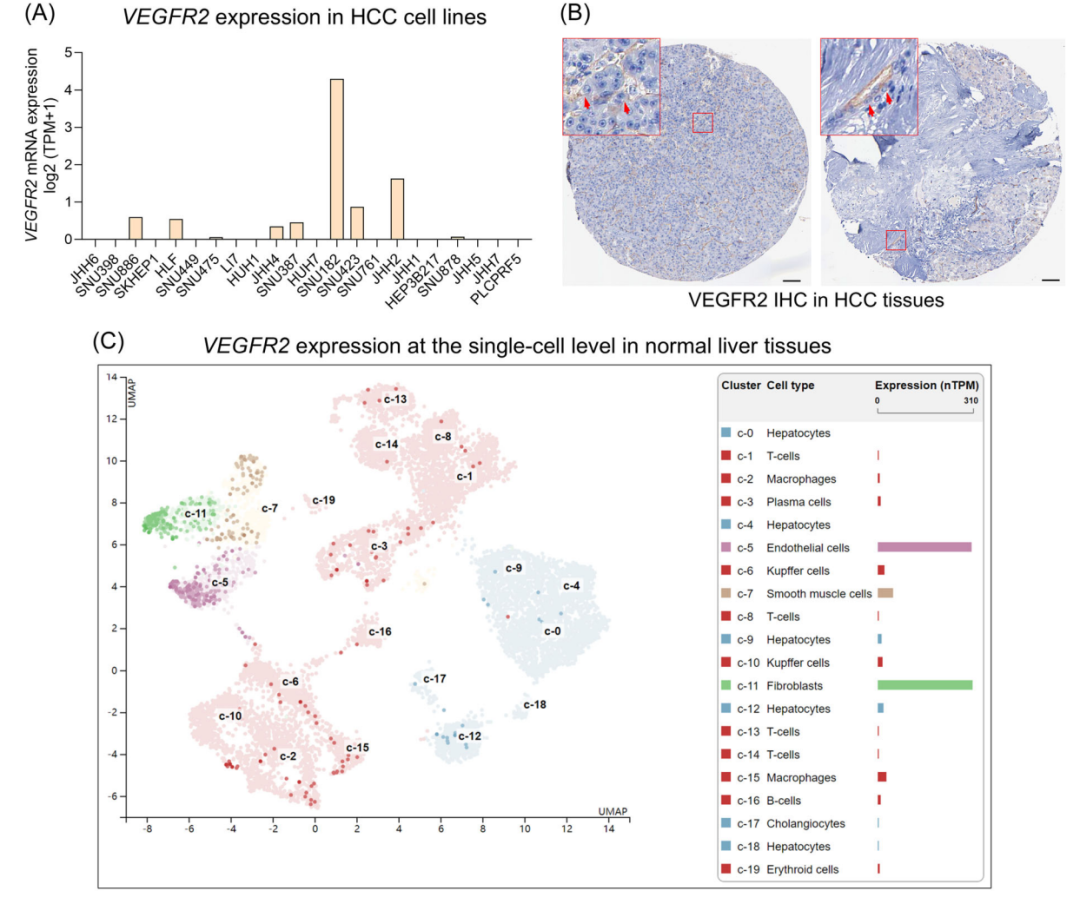
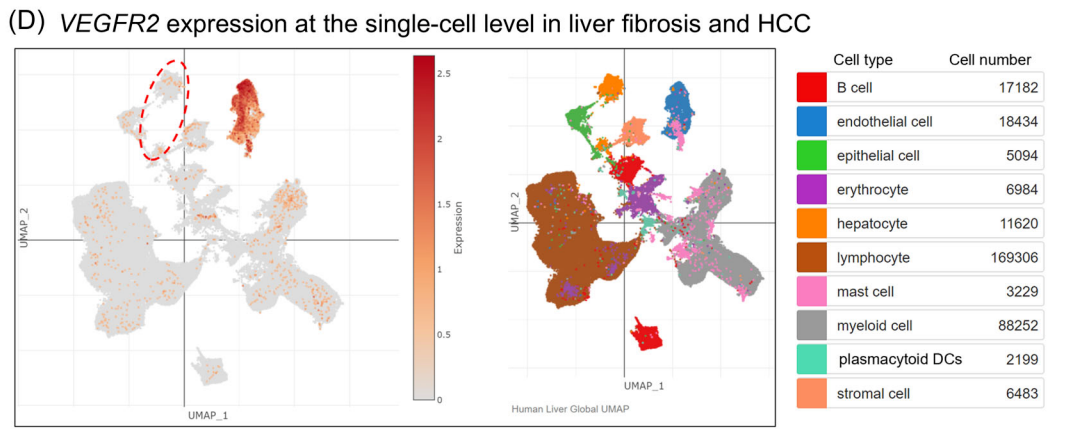
▲图2 VEGFR2在不同细胞中的表达差异
▎HCC肿瘤细胞可通过原发肿瘤内皮细胞来源的细胞外囊泡获得VEGFR2 mRNA
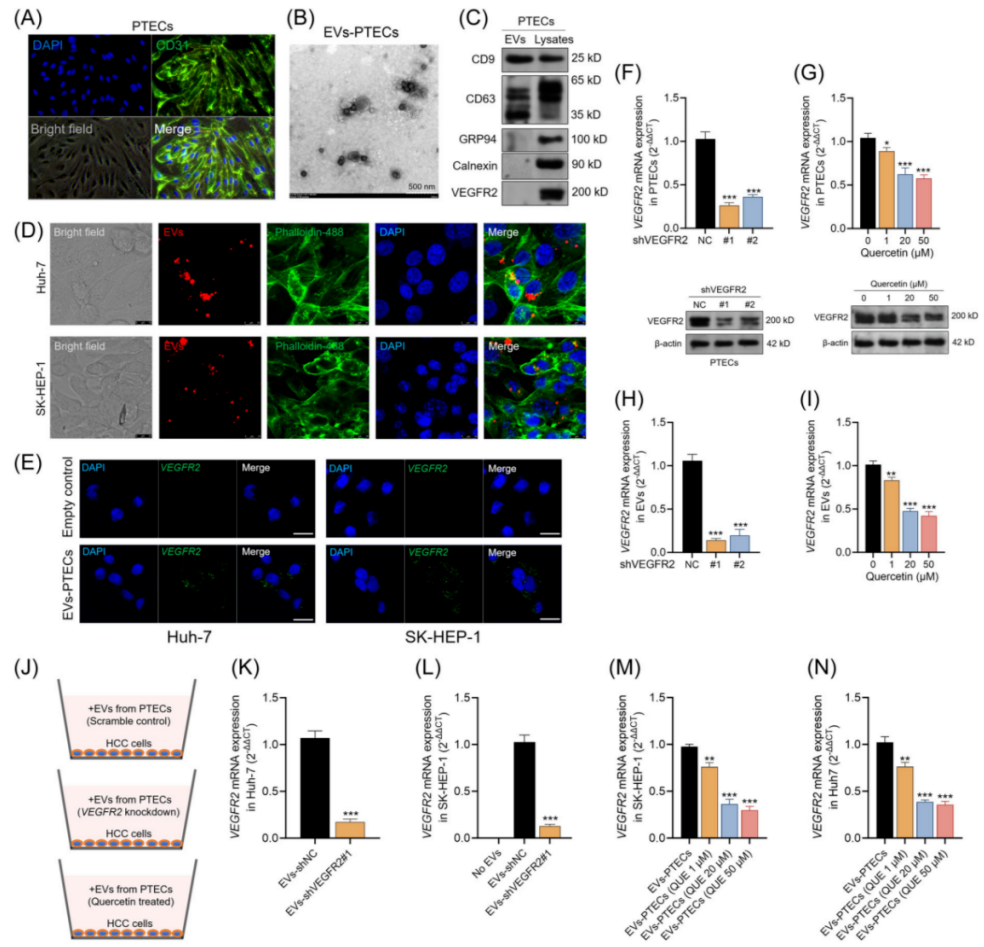
▲图3 HCC肿瘤细胞可通过PTECs衍生的EVs获得VEGFR2 mRNA
槲皮素可以通过抑制VEGFR2 mRNA的表达和VEGFR2蛋白的磷酸化来抑制多种类型肿瘤的血管生成,本实验研究还发现,在PTECs中,槲皮素处理以剂量依赖性的方式降低了VEGFR2 mRNA的表达(图3G)。与对照组相比,经槲皮素处理的PTECs的EV的VEGFR2 mRNA载量也显著降低(图3I)。用槲皮素处理的PTECs EV的受体HCC细胞VEGFR2 mRNA水平显著低于未处理PTECs的HCC细胞(图3M,N),再次证实了槲皮素可以抑制VEGFR2 mRNA表达。
▎HCC肿瘤细胞可通过原发肿瘤内皮细胞来源的细胞外囊泡获得VEGFR2 mRNA
IF染色和流式细胞仪分析证实,与EVs-shNC共培养12h后,HCC细胞的细胞膜中存在VEGFR2蛋白(图4A,白色箭头,图4B,C)。然而,在与槲皮素-shVEGFR2或来自槲皮素处理的PTECs的ev共培养的HCC细胞中,这种现象明显减弱(图4A−C)。
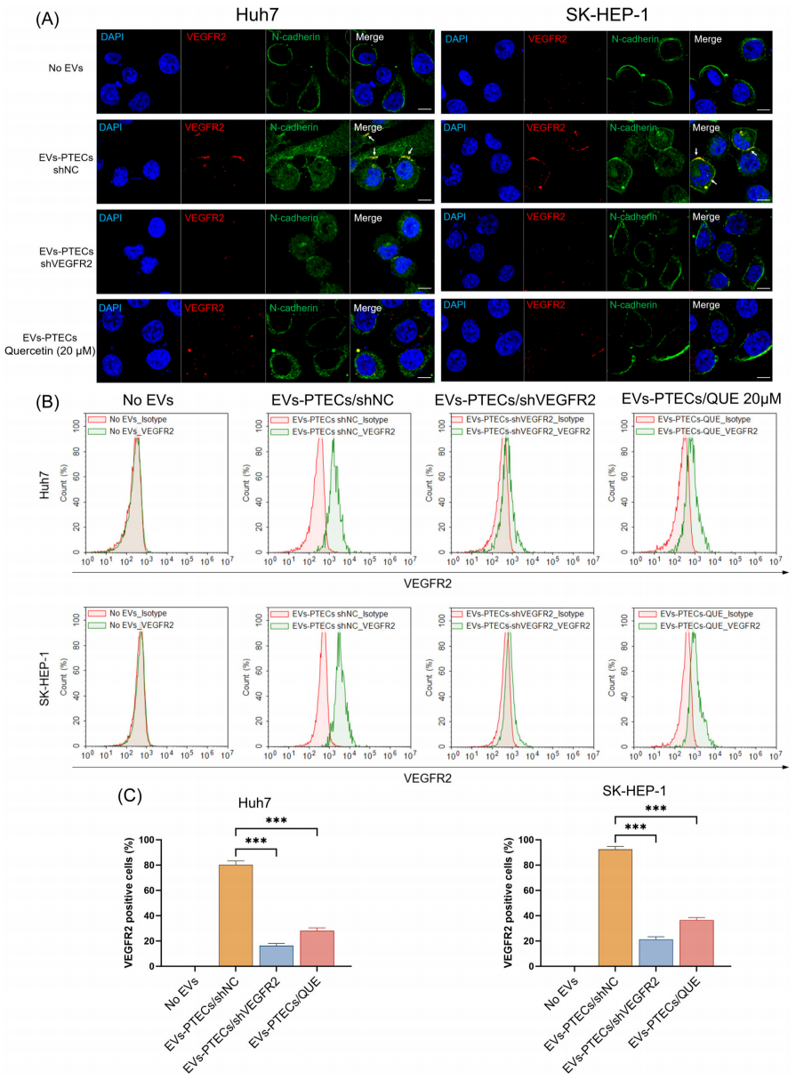
▲图4 槲皮素抑制HCC肿瘤细胞中VEGFR2蛋白的表达
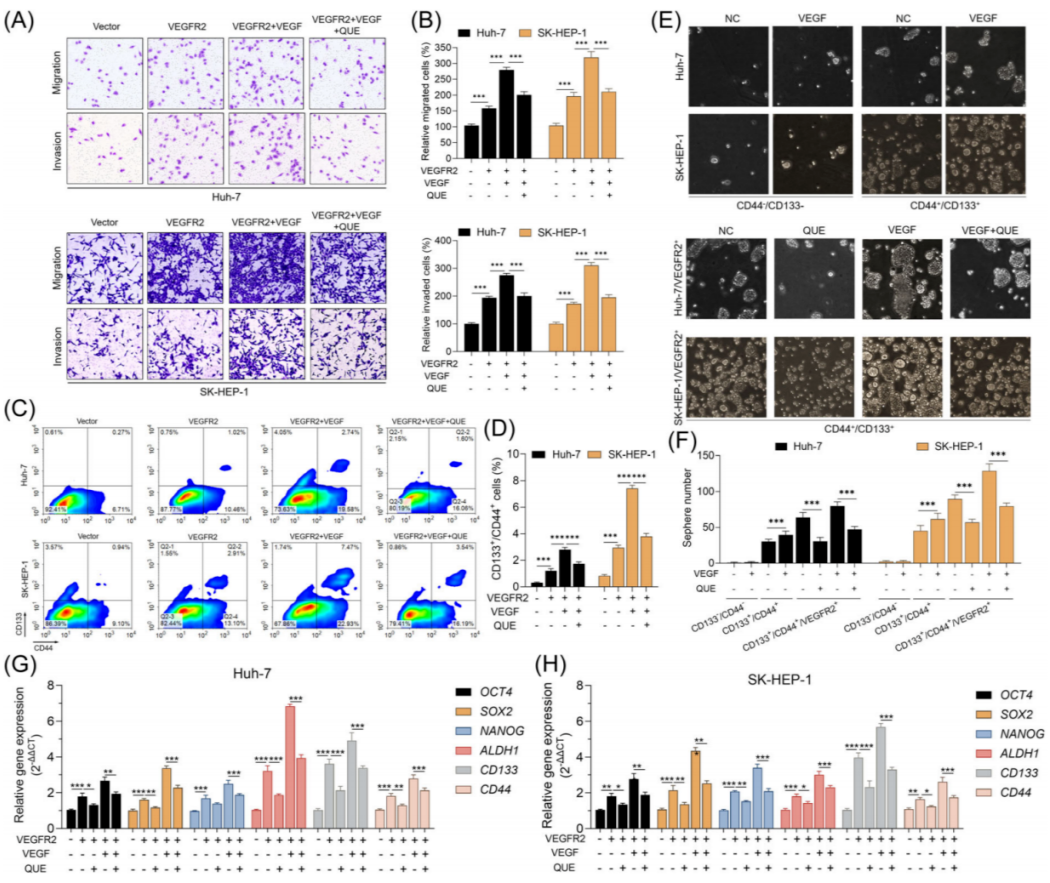
▲图5 槲皮素削弱vegfr2介导的,并增强HCC细胞的侵袭、转移和CSC特性
▎槲皮素减少异种移植瘤模型中VEGF分泌和VEGFR2阳性CTC
-qPCR和ELISA数据显示,与载体对照相比,过表达VEGFR2的Huh-7和SK-HEP-1细胞均增强了VEGF mRNA转录和更多的VEGF分泌,而槲皮素治疗大大抑制了这些趋势(图6A,B0。
-试管形成实验显示,与培养基对照相比,来自Huh-7和SK-HEP-1细胞的CM均显著促进了PUMC-HUVEC-T1细胞的试管形成能力,VEGFR2的过表达显著增强了这些作用,但同时槲皮素处理减弱了这些作用(图6C,D)。
-使用裸鼠生成huh-7来源的异种移植瘤模型,结果显示这些过表达VEGFR2的肿瘤细胞系的生长速度明显更快(图6E,F),肿瘤内的血管形成更强(图6G)。槲皮素治疗大大削弱了这些趋势(图6E−G)。
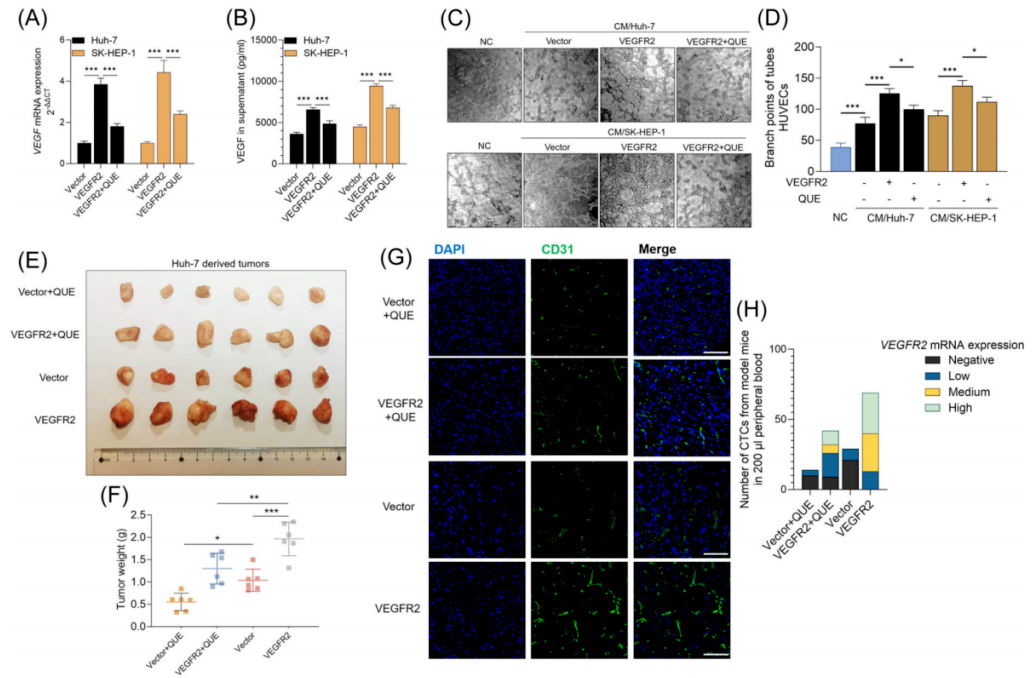
▲图6 槲皮素减少移植瘤模型中VEGF分泌和VEGFR2阳性CTC
研究结论
![]()
展望
![]()
1.Huang Q, Li S, Hu X, et al. Shear stress activates ATOH8 via autocrine VEGF promoting glycolysis dependent‐survival of colorectal cancer cells in the circulation. J Exp Clin Cancer Res. 2020;39(1):25.
2.Quercetin inhibits endothelial & hepatocellular carcinoma cell crosstalk via reducing extracellular vesicle-mediated VEGFR2 mRNA transfer.













