
循环肿瘤细胞(CTCs)的检测已成为临床癌症诊断和监测的有效工具。核苷酸切除交叉修复基因1(ERCC1)和CTC上皮间质转化(EMT)的表达与治疗效果有关。通过CTCs表型及ERCC1表达检测,对深入研究鼻咽癌临床预后相至关重要。
01 纳入人群
![]()
本研究纳入2018年11月至2021年11月期间接受CanPatrol® CTC检测的108名新诊断为局部晚期鼻咽癌的患者。
纳入标准:(1) 组织病理学诊断为NPC,(2) 第八版UICC/AKCC分期系统分类为III-IVa期,(3) 无抗肿瘤治疗或其他恶性肿瘤的既往史,(4) Karnofsky绩效评分≥70,(5) 成功完成规定的放射治疗方案。
02 研究方法
![]()
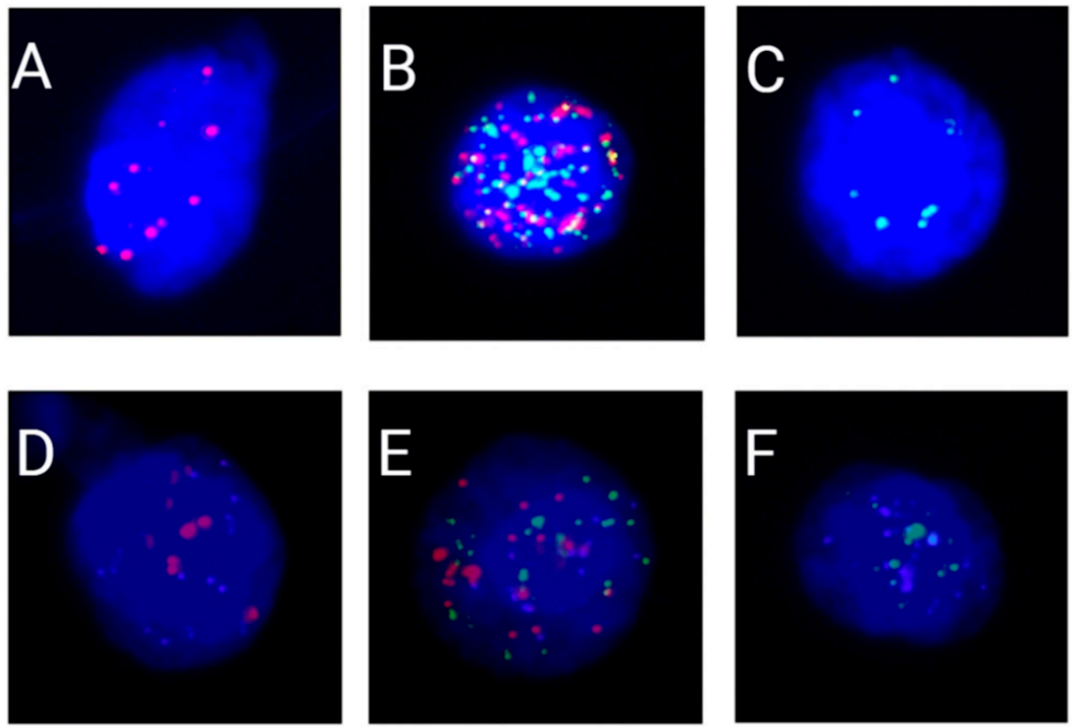
▲图1 不同EMT亚型CTCs和CTCs ERCC1的荧光显微图像
A. 上皮型和ERCC1阴性CTC(红色荧光); B. 混合型和ERCC1阴性CTC(红+绿荧光); C. 间充质型和ERCC1阴性CTC(绿色荧光); D. 上皮型和ERCC1阳性CTC(红色+紫色荧光); E. 混合型和ERCC1阳性CTC(红+绿+紫色荧光); F. 间充质型和ERCC1阳性CTC(绿色+紫色荧光)
03 疗效评估
![]()
04 随访
![]()
05 统计分析
![]()
06 研究结果
![]()
1 患者的临床病理特征
表3 鼻咽癌患者的临床特征
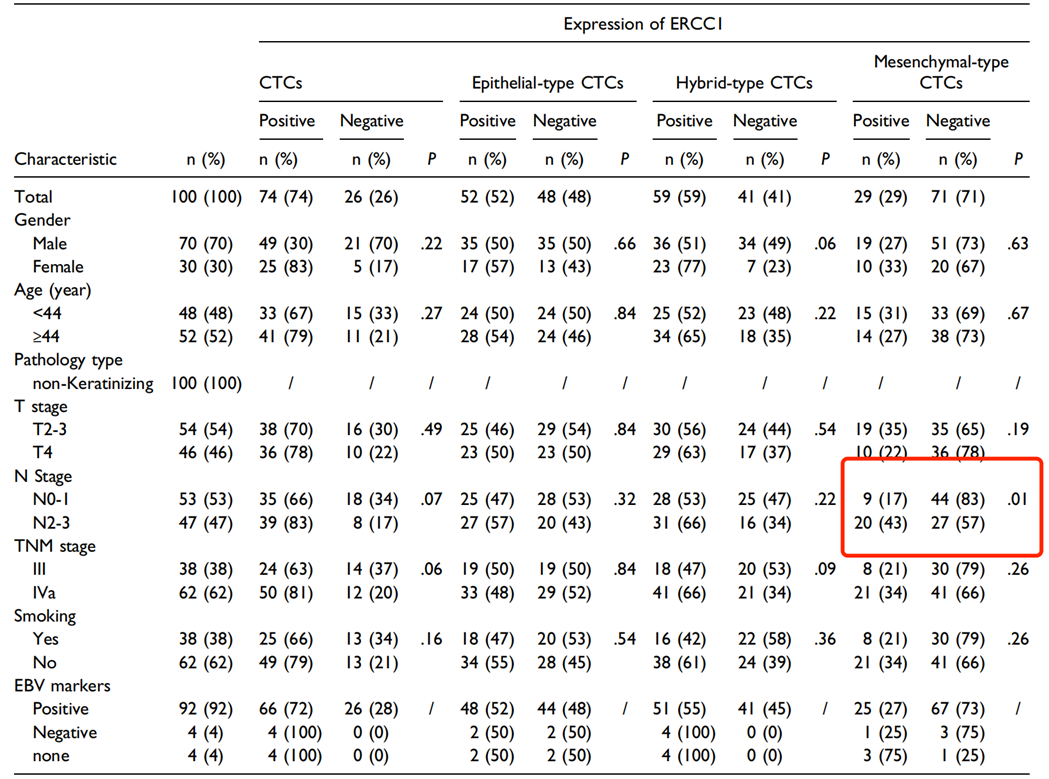
2 CTC ERCC1表达及其临床特征
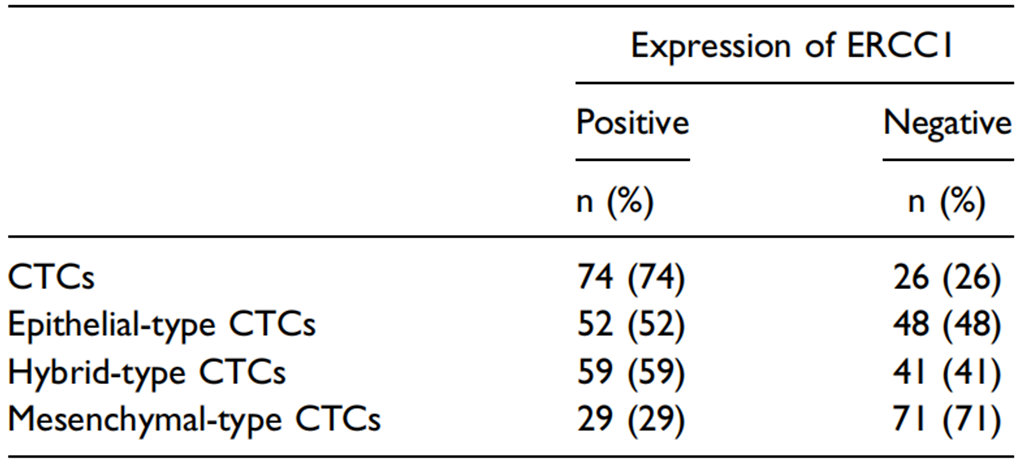
CTC阳性率为93%(100/108),EMT分类和ERCC1表达分类见表4。
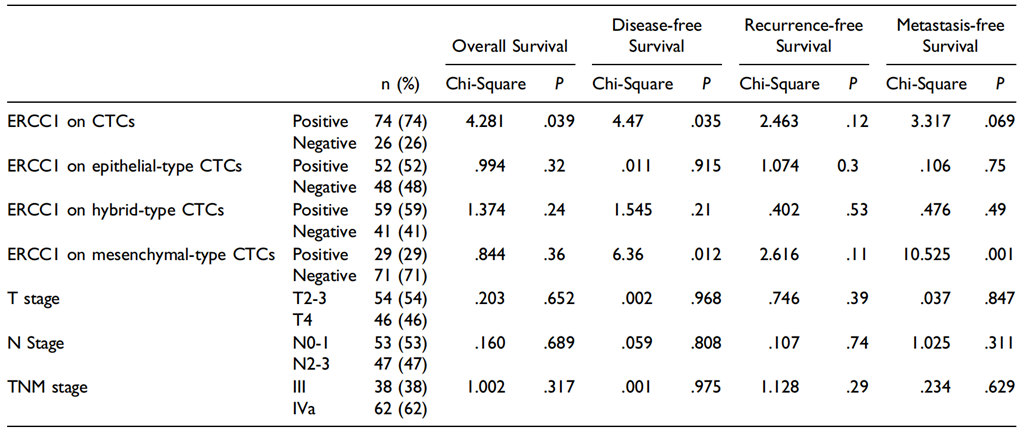
100名CTC阳性患者亚组中,ERCC1阳性率为74%(74/100)。在组间分析中,结果表明ERCC1表达与临床特征之间没有显著相关性(表3)。CTC EMT亚型的ERCC1表达分析发现,间质型CTC ERCC1的表达与患者的N分期显著相关(P=0.01)。上皮型和混合型CTC ERCC1与患者N分期无关(P>0.05)。此外,ERCC1表达与性别、年龄、T分期、TNM分期和吸烟状况等其他临床特征之间没有显著相关性(表3)。
表4 CTC EMT亚型和 ERCC1表达
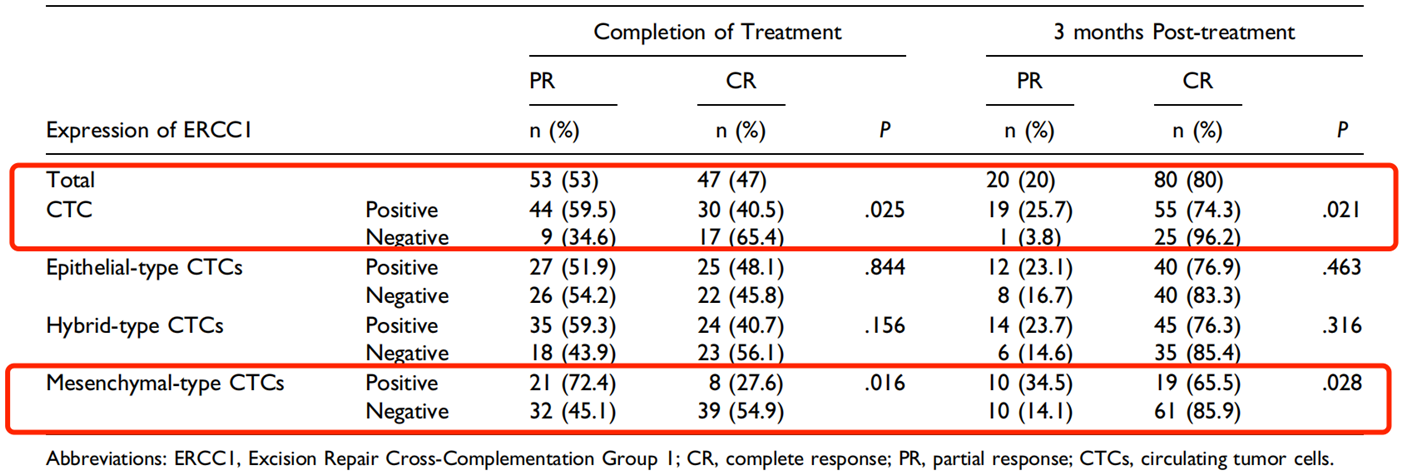
3 CTC ERCC1表达与治疗疗效相关性
在100名CTC检测呈阳性的患者队列中,47名患者(47%)在治疗结束时达到CR,53名患者(53%)达到PR。治疗后3个月,80名患者(80%)达到CR,20名患者(20%)达到PR。
对CTC上ERCC1的表达和治疗反应进行亚组分析,结果显示,治疗结束时,ERCC1阳性亚组的CR率(30/74,40.5%)明显低于ERCC1阴性亚组(17/26,65.4%)(P=0.025)(表5)。治疗3个月后,ERCC1阳性亚组的CR率(55/74,74.3%)低于ERCC1阴性亚组(25/26,96.2%),差异具有统计学意义(P=0.021)。
此外,治疗结束时,间质型CTC ERCC1阳性亚组的CR率(8/29,27.6%)低于ERCC1阴性亚组(39/71,54.9%),差异具有统计学意义(P=0.016)。治疗3个月后,ERCC1阳性亚组的CR率(19/29,65.5%)低于ERCC1阴性亚组(61/71,85.9%),差异具有统计学意义(P=0.028)。在上皮型和杂交型CTC中,没有观察到ERCC1表达与治疗疗效之间存在相关性(表5)。
表5 鼻咽癌患者CTCs ERCC1表达与临床疗效的相关性
4 CTC ERCC1表达与预后
对100名CTC阳性患者进行随访,中位随访时间为32个月(10至58个月)。3年总生存率(OS)、无病生存率(DFS)、无复发生存率(RFS)和无转移生存率(MFS)分别为89%、82%、93%和85%。
进一步分析CTC ERCC1表达与患者预后之间的关系,研究发现CTC上ERCC1表达与更差OS(P=0.039)(图2)和DFS(P=0.035)(图3)之间显著相关。ERCC1表达与RFS或MFS之间没有显著相关性。评估ERCC1表达与EMT亚型预后的关系,结果显示,间质型CTC ERCC1表达与较差的DFS(P=0.012)(图4)以及MFS(P=0.001)(图5)显著相关,未观察到与OS和RFS有显著关联。此外,T期、N期、TNM期、上皮和混合型CTC上ERCC1的表达与患者预后之间没有显著相关性(表6)。
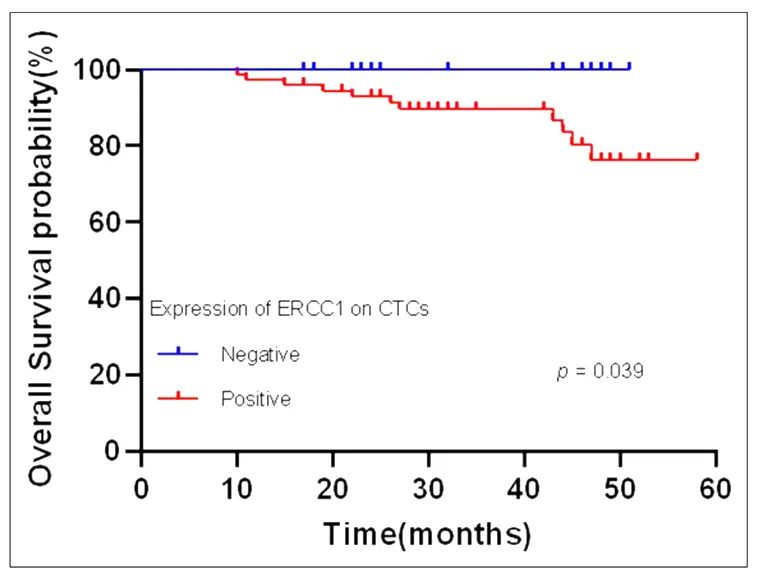
▲图2 CTC ERCC1表达与OS的Kaplan-Meier生存曲线
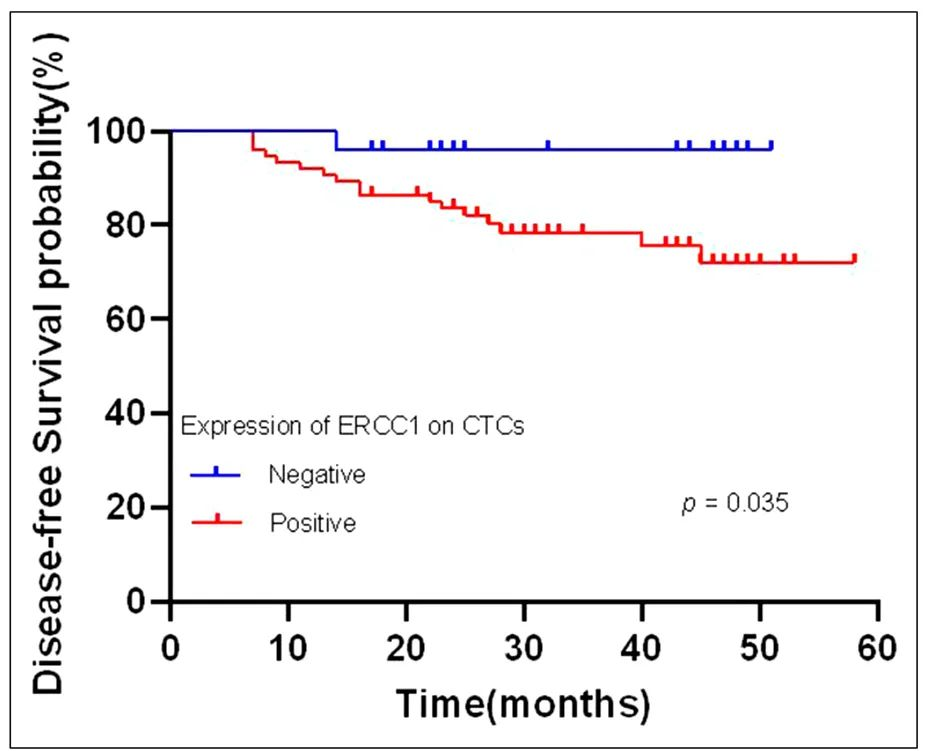
▲图3 CTC ERCC1表达与DFS的Kaplan-Meier生存曲线
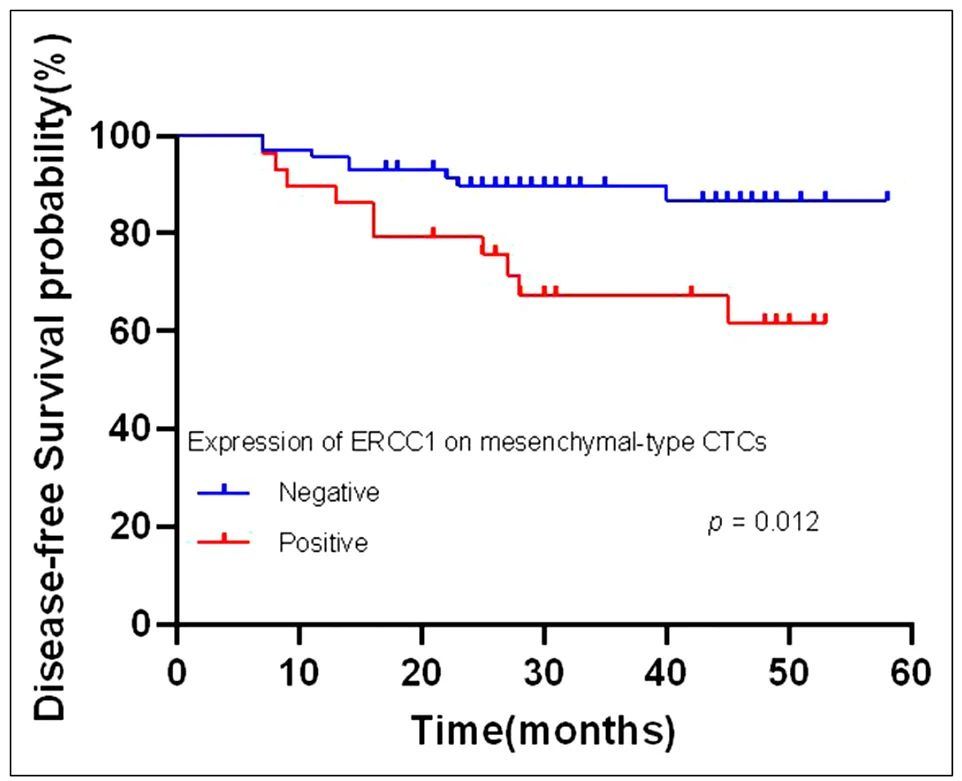
▲图4 间质型CTC ERCC1表达与DFS的Kaplan-Meier生存曲线
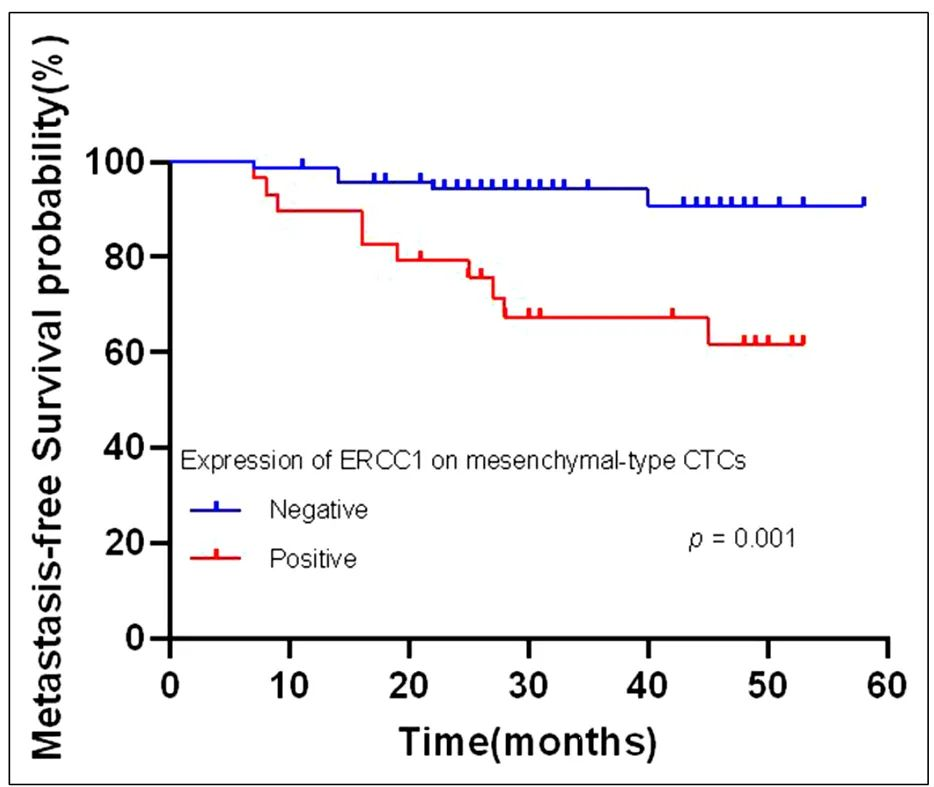
▲图5 间质型CTC ERCC1表达与MFS的Kaplan-Meier生存曲线
表6 鼻咽癌患者预后因素Kaplan-Meier分析
07 研究结论
![]()
参考文献:
1.Chang ET, Ye W, Zeng Y-X, Adami H-O. The evolving epidemiology of nasopharyngeal carcinoma. Cancer Epidemiol Biomarkers Prev. 2021;30(6):1035-1047.
2.Chen Y-P, Chan ATC, Le Q-T, Blanchard P, Sun Y, Ma J. Nasopharyngeal carcinoma. Lancet. 2019;394(10192):64-80.
3.Wong KCW, Hui EP, Lo K-W, et al. Nasopharyngeal carcinoma: an evolving paradigm. Nat Rev Clin Oncol. 2021;18(11): 679-695.
4.Lee AWM, Ma BBY, Ng WT, Chan ATC. Management of nasopharyngeal carcinoma: current practice and future perspective. J Clin Oncol. 2015;33(29):3356-3364.
5.Chen Y-P, Liu X, Zhou Q, et al. Metronomic capecitabine as adjuvant therapy in locoregionally advanced nasopharyngeal carcinoma: a multicentre, open-label, parallel-group, randomised, controlled, phase 3 trial. Lancet. 2021;398(10297): 303-313.
6.Zhang Y, Chen L, Hu G-Q, et al. Gemcitabine and cisplatin induction chemotherapy in nasopharyngeal carcinoma. N Engl J Med. 2019;381(12):1124-1135.
7.Sun Y, Li W-F, Chen N-Y, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicentre, randomised controlled trial. Lancet Oncol. 2016;17(11):1509-1520.
8.Liu T, Li YQ, Song JM, Li B, Wang RS, Huang TT, Qin YT, Prognostic Significance of Excision Repair Cross-Complementation Group 1 on Circulating Tumor Cells for Nasopharyngeal Carcinoma.Cancer Control. 2024 Jan-Dec:31:10732748241251562.
9.Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228-247.
10.Tang LL, Chen YP, Chen CB, et al. The Chinese Society of Clinical Oncology (CSCO) clinical guidelines for the diagnosis and treatment of nasopharyngeal carcinoma. Cancer Commun. 2021;41(11):1195-1227.













